Biologija EpCAM na strukturnem nivoju kot osnova za učinkovito tumorsko ciljanje

Šifra projekta: J1-7119 (D)
Vodja projekta: prof. dr. Brigita Lenarčič
Financiranje: Javna agencija za raziskovalno dejavnost Republike Slovenije (ARRS)
Obdobje financiranja: 1. 1. 2016 – 31. 12. 2018
Člani projektne skupine
Povezave vodijo na strani raziskovalcev v bazi SICRIS.
- prof. dr. Brigita Lenarčič (UL FKKT), vodja projekta
- prof. dr. Kristina Djinović-Carugo (UL FKKT)
- prof. dr. Jurij Svete (UL FKKT)
- doc. dr. Miha Pavšič (UL FKKT)
- Aljaž Gaber, univ dipl. biokem. (UL FKKT)
- prof. dr. Janez Plavec in dr. Martina Lenarčič Živković (Kemijski institut, Ljubljana)
- prof. dr. Tamara Lah Turnšek in dr. Helena Motaln (Nacionalni institut za biologijo, Ljubljana)
Uvod
Kolorektalni rak ter rak prostate, dojk in pljuč ostajajo poglavitni zdravstveni problemi tako v smislu pogostosti kot tudi smrtnosti. Klasične strategije zdravljenja vključujejo operativne posege, radiacijske terapije in/ali kemoterapije, novejši trendi pa se naslanjajo predvsem na usmerjene terapije. Pri tem je pomembno izpostaviti, da je za uspešno ciljanje rakavih celic nujno razumevanje celične heterogenosti in plastičnosti tekom metastatske kaskade, tudi v smislu epitelijsko-mezenhimskega prehoda (EMT/MET). V luči tega je bil v zadnjih desetletjih narejen precejšen napredek v smislu identifikacije in podrobnih raziskav primernih označevalnih molekul ter z rakom povezanih dogodkov na molekularnem nivoju. Ena od molekul, ki je bila in je še zmeraj deležna precejšnje pozornosti, je EpCAM (CD326). Ta molekula je s tumorskimi celicami povezan transmembranski antigen, ki sodeluje pri pospeševanju celične proliferacije in pri medcelični adheziji. Značilna je za zarodne in karcinomske celice in kot taka je tarča številnih proti-tumorskih terapevtskih pristopov, a slednji se soočajo z nizko uspešnostjo zaradi omejene vezave terapevtskih molekul na EpCAM, predvidoma zaradi sprememb v hitrost recikliranja EpCAM, povezave EpCAM z drugimi z rakom povezanimi proteini in dostopnostjo zaradi trans-celične oligomerizacije.
Naša raziskovalna skupina z UL FKKT je nedavno z določitvijo kristalne strukture EpCAM naredila precejšen napredek na področju strukturne biologije te zanimive molekule, saj nam je omogočila razlago številnih funkcijskih vidikov, a veliko vprašanj je ostalo neodgovorjenih, predvsem v smislu oligomerizacije EpCAM, povezave EpCAM s klavdinom-7 v signalne komplekse, ki pospešujejo celično proliferacijo, ter povezavo med EpCAM in citoskeletom preko alfa-aktinina.
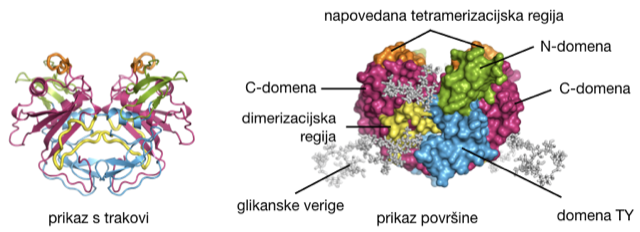
Shematski prikaz strukture dimera zunajceličnega dela EpCAM, kot se nahaja na površini celic. [Pavšič in sod., Nature Communications, 2014]
Cilji
Splošen cilj projekta je nasloviti pomanjkanje vedenja o biologiji EpCAM in Trop2, posebej v luči strukturnih značilnosti njunih oligomerov in kompleksov z drugimi molekulami/proteini, za namene izboljšave obstoječih ali načrtovanje novih protitumorskih terapij. V okviru tega smo oblikovali več specifičnih ciljev, ki obsegajo podrobno karakterizacijo skupkov EpCAM in Trop2 na površini celic, predvsem v smislu strukture in funkcije (adhezija) ter interakcij z drugimi molekulami, in raziskave vloge glikozilacije in vezave majhnih (regulatornih) molekul na zunajcelični del EpCAM/Trop2.
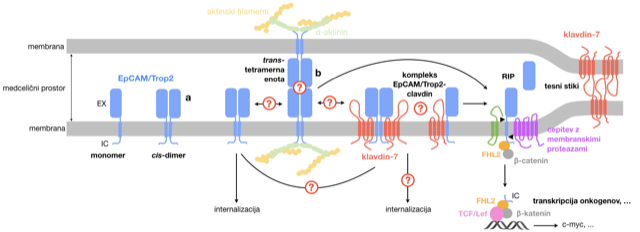
Shematski prikaz vidikov funkcije EpCAM, povezanih s specifičnimi cilji (označeni z ?).
Metode
Pri raziskavah uporabljamo zraven osnovnih metod (metode molekulskega kloniranja, izražanja rekombinantnih proteinov ter njihovega čiščenja in osnovne karakterizacije) še širok spekter drugih metod, ki nam omogočajo vpogled v:
- medproteinske interakcije: termoforeza v mikromerilu (MST), površinska plazmonska resonanca (SPR), masna spektroskopija po prečnem kemijskem povezovanju (CX-MS);
- strukturo: rentgenska kristalografija, jedrska magnetna resonanca (NMR), ozkokotno sipanje rentgenske svetlobe (SAXS), modeliranje strukture posameznih proteinov in njihovih kompleksov ter simulacije molekulske dinamike;
- funkcijo: različni in vitro in in vivo modeli (celične kulture).
Faze projekta
Projekt je razdeljen na več faz, od katerih so začetne namenjene pripravi rekombinantnih proteinov v različnih oblikah (fuzije, mutanti) ter računalniške analize (analize struktur, virtualno presejanje, modeliranje kompleksov), na rezultatih katerih temeljijo kasnejše faze – podrobnejša strukturna in funkcijska karakterizacija.
Rezultati
Glavna rezultata projekta, ki smo jih predstavili v dveh znanstvenih člankih, sta:
- dokaz, da EpCAM dejansko ne deluje kot homofilna celična adhezijska molekula in da na celični površini tvori zgolj cis-dimere in ne tetramerov ipd., kar se je predvidevalo do sedaj - to postavlja EpCAM v popolnoma novo perspektivo, naši rezultati pa so pomembni pri razumevanju drugih procesov, v katere je vključen EpCAM - signaliziranje preko RIP in interakcije z drugimi proteini; večina eksperimentov je bila izvedenih na naši katedri, del pa v sodelovanju z raziskovalci z UCSF (ZDA) in Kemijskega inštituta (Ljubljana); članek je bil objavljen v ugledni reviji Scientific Reports (2-letni IF za 2017 4,1);
- demonstracija neposredne interakcije med EpCAM in EGFR (receptor za epidermalni rastni faktor), kar je izrednega pomena za razumevanje signalnih poti, pri katerih sodeluje EpCAM; rezultat je del obširnejše objave skupine prof. Olivierja Giresa (LMU München, Nemčija), s katero že več let plodno sodelujemo; članek je bil objavljen v ugledni reviji PLoS Biology (2-letni IF za 2017 9,2).
Pri raziskavi homo-oligomerizacije EpCAM in njene vloge v medcelični adheziji smo uporabljali različne pristope, s katerimi smo potrdili, da:
- zunajcelični del molekule v raztopini tvori zgolj dimere in ne oligomerov višjega reda, pri čemer smo uporabili ozkokotno sipanje rentgenske svetlobe, kar nam je omogočijo analizo velikosti delcev v raztopini in s tem sklepanje na oligomerno stanje EpCAM;
- so oligomeri višjega reda (trimeri, tetrameri), ki jih lahko opazimo po kemijskem prečnem povezovanju, pravzaprav artefakti oz. so posledica naključne prečne povezave med monomeri ali dimeri v raztopini (uporabljena metoda: kemijsko prečno povezovanje in analiza z masno spektroskopijo;
- EpCAM ne facilitira združevanja mikroskopsko majhnih kroglic (analogija celice), prekritih bodisi z zunajceličnim delom ali celotnim EpCAM (metoda: analiza agregacije kroglic);
- na medceličnih stikih celic, ki izražajo EpCAM, so opazni dimeri EpCAM (in sicer cis-dimeri, ki nastanejo preko interakcij dveh podenot z iste celice), ni pa moč opaziti oligomerov višjega razreda, ki bi bili posledica povezovanja cis-dimerov s sosednjih celic; pri tem smo uporabili metodo FLIM-FRET, ki temelji na merjenju življenjske dobe fluorescence v povezavi z efektom FRET.
Vse navedene metode so dale skladne rezultate, na osnovi katerih smo zaključili, da je več kot dvajsetletno pojmovanje EpCAM kot homofilne medcelične adhezijske molekule, ki facilitira medcelično adhezijo preko homo-oligomerizacije, napačno.
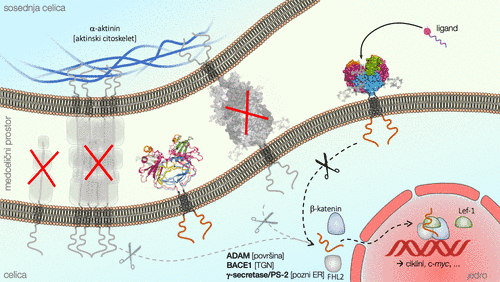
Shematski prikaz nekaterih rezultatov v okviru projekta: EpCAM se na celični površini ne nahaja kot monomer ali homo-oligomer višjega razreda (npr. oktamer, kot predvidevano v preteklosti), temveč kot cis-dimer (v sredini levo); trans-tetramerna medcelična adhezijska enota ne obstaja (v sredini desno), zato tudi ne more biti sprožilec signaliziranja preko regulirane znotrajmembranske cepitve (spodaj); s slednjo je verjetno povezava vezava še neznanega liganda na zunajcelični del (desno; še neobjavljeni rezultati).
Reference raziskovalne skupine, povezane s tematiko projekta
- S. Drmota Prebil, U. Slapšak, M. Pavšič, G. Ilc, V. Puž, E. de Almeida Ribeiro, D. Anrather, M. Hartl, L. Backman, J. Plavec, B. Lenarčič in K. Djinović-Carugo. Structure and calcium-binding studies of calmodulin-like domain of human non-muscle -actinin-1. Scientific Reports, 6:27383, 2016. (DOI 10.1038/srep27383)
- M. Pavšič, G. Gunčar, K. Djinović-Carugo in B. Lenarčič. Crystal structure and its bearing towards an understanding of key biological functions of EpCAM. Nature Communications, 5:4764, 2014. (DOI 10.1038/ncomms5764)
- M. Pavšič, G. Ilc, T. Vidmar, J. Plavec in B. Lenarčič. The cytosolic tail of the tumor marker protein trop2–a structural switch triggered by phosphorylation. Scientific Reports, 5:10324, 2015. (DOI 10.1038/srep10324)
- M. Pavšič in B. Lenarčič. Expression, crystallization and preliminary X-ray characterization of the human epithelial cell-adhesion molecule ectodomain. Acta Crystallographica Section F, Structural Biology and Crystallization Communications, 67(Pt 11):1363–1366, 2011. (DOI 10.1107/S1744309111031897)
- T. Tsaktanis, H. Kremling, M. Pavšič, R. von Stackelberg, B. Mack, A. Fukumori, H. Steiner, F. Viel- muth, V. Spindler, Z. Huang, J. Jakubowski, N. H. Stoecklein, E. Luxenburger, K. Lauber, B. Lenarčič in O. Gires. Cleavage and cell adhesion properties of human epithelial cell adhesion molecule (hepcam). Journal of Biological Chemistry, 290(40):24574–91, 2015. (DOI 10.1074/jbc.M115.662700)
- T. Vidmar, M. Pavšič in B. Lenarčič. Biochemical and preliminary X-ray characterization of the tumor-associated calcium signal transducer 2 (Trop2) ectodomain. Protein Expression and Purification, 91(1):69–76, 2013. (DOI 10.1016/j.pep.2013.07.006)