Strukturne osnove regulacije človeškega alfa-aktinina s kalcijem

Šifra projekta: J1-8151 (D)
Vodja projekta: prof. dr. Kristina Djinović-Carugo
Financiranje: Javna agencija za raziskovalno dejavnost Republike Slovenije (ARRS)
Obdobje financiranja: 1. 5. 2017 – 30. 4. 2020
Člani projektne skupine
Povezave vodijo na strani raziskovalcev v bazi SICRIS.
- prof. dr. Kristina Djinović-Carugo (UL FKKT in Univerza na Dunaju), vodja projekta
- prof. dr. Brigita Lenarčič (UL FKKT)
- dr. Sara Drmota Prebil (UL FKKT)
- doc. dr. Miha Pavšič (UL FKKT)
- prof. dr. Janez Plavec (Kemijski inštitut, Ljubljana)
- dr. Gregor Ilc (Kemijski inštitut, Ljubljana)
Predstavitev problematike
Citoskelet je notranje celično ogrodje, ki celici omogoča tako “statičnost” (obliko in trdnost) kot dinamičnost (premikanje organelov, celična delitev, znotrajcelični transport, …). Eden izmed tipov citoskeleta je aktinski citoskelet, ki igra ključno vlogo pri številnih pomembnih celičnih procesih kot so, na primer, kontrakcija mišičnih celic, celična gibljivost, signaliziranje, znotrajcelični transport in vzdrževanje oblike in stabilnosti celic. Osrednja komponenta aktinskega citoskeleta so aktinski filamenti, pri opravljanju različnih funkcij pa se povezujejo drugimi proteini.
Eni izmed glavnih proteinov, ki prečno povezujejo aktinske filamente, so alfa-aktinini. Identificirane so bile štiri izooblike človeških α-aktininov: od kalcija neodvisna mišična aktinina (izoobliki 2 in 3), ki prečno povezujeta aktinske filamente v kompleksih Z-diska med sarkomerami, in od kalcija odvisni nemišični izoobliki (izoobliki 1 in 4). Nemišišče izooblike najdemo v vseh tipih celic kjer prečno povezujejo in s tem organizirajo aktinske filamente v dva osnovna tipa struktur: tridimenzionalne mreže, kjer so aktinski filamenti orientirani v različnih smereh, in snopi tesno pakiranih vzporednih aktinskih filamentov. Snopi delujejo kot ogrodja, ki podpirajo ali stabilizirajo celične strukture kot so stiki pri fokalni adheziji, celični izrastki in stresna vlakna. Nemišične izooblike so odgovorne za povezave med citoskeletom in različnimi signalnimi potmi, regulatornimi receptorji in membranskimi proteini.
Lastnost alfa-aktinina, da navzkrižno povezuje aktinske filamente, je neločljivo povezana z njegovo organizacijo domen (slika spodaj), kjer se dve aktin-vezavni domeni (ABD) nahajata na nasprotnih koncih antiparalelnega dimera, ki je stabiliziran preko obsežnih interakcij med osrednjo paličasto domeno, sestavljeno iz štirih spektrinskih ponovitev (SR1-4). Domena ABD je povezana s paličasto domeno preko fleksibilnega vratu. Blizu slednje se nahaja kalmodulinu-podobna domena (sestavljena iz EF1-2 in EF3-4) sosednje podenote, ki je vključena v regulacijo aktin-povezovalne aktinosti alfa-aktinina. Nemišični alfa-akinini se odzivajo na kalcijeve ione, ki inhibirajo prečno povezovanje F-aktina in deloma tudi samo vezavo alfa-aktina na F-aktin.

Slika 1: shema zgradbe alfa-aktinina-1.
Kalmodulinska proteinov, ki vežejo kalcijeve ione, je sestavljena iz N- in C-končne regije, od katerih je vsaka sestavljena iz para interagirajočih dlani EF (EF1-2 in EF3-4). Vezava kalcijevih ionov stabilizira delno nestrukturirano zanko in zmanjša notranjo mobilnost elementov domene, hkrati pa pride tudi do konformacijskih spremem, ki rezultirajo v izpostavitvi velikih hidrofobnih površin na vsaki od obeh regij (prehod iz zaprtega v odprto obliko) in v končni fazi do povečane afinitete do interakcijskih partnerjev. Aktivnost nemišičnih alfa-aktininov, da navzkrižno povezujejo aktinske filamente, je zmanjšana ali celo preprečena pri koncentracijah kalcija, višjih od 10–7 M, molekularna osnova tega regulatornega mehanizma pa ostaja nepojasnjena. Pomemben vpogled v ta mehanizem bi dali podrobni strukturni podatki, kar je osnovni cilj našega projekta (slika 2).
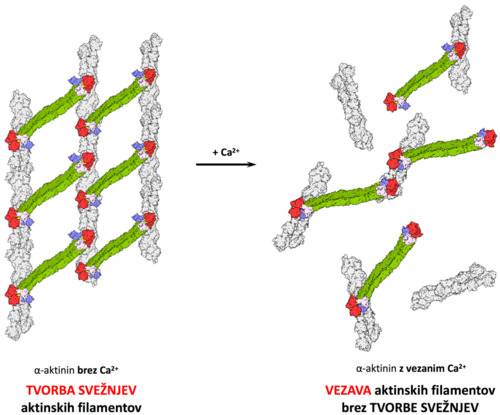
Slika 2: model vezave kalcijevih ionov na alfa-aktinin in njen vpliv na delovanje alfa-aktinina.
Cilji
Glavni cilj projekta je pojasnitev mehanizma regulacije človeškega alfa-aktinina s kalcijem na molekularnem nivoju. Osrednje vprašanje, na katerega bomo poizkusili odgovoriti je, kakšne konformacijske spremembe povzroči vezava kalcija in kako vplivajo na sposobnost prečnega povezovanja aktina. Da bi odgovorili na to vprašanje bomo najprej pridobili strukturne, biofizikalne in funkcijske podatke o človeškem alfa-aktininu-1.
Metode
Pri raziskavah uporabljamo zraven osnovnih metod, ki nam omogočajo pripravo vzorcev za druge študije (metode molekulskega kloniranja, izražanja rekombinantnih proteinov ter njihovega čiščenja in osnovne karakterizacije), še širok spekter drugih metod:
- biofizikalna karakterizacija: dinamično sipanje svetlobe ter sipanje laserske svetlobe pod različnimi koti, sklopljeno z velikostno izključitveno kromatografijo (SEC-MALLS), izotermna titracijska kalorimetrija (ITC), termoforeza v mikromerilu (MST), ko-sedimentacija;
- strukturne študije: makromolekulska kristalografija, krioelektronska mikroskopija, jedrska magnetna resonanca, fluorescenčna korelacijska spektroskopija;
- celični eksperimenti: utišanje genov, vnos rekombinantne DNA v celice, konfokalna mikroskopija.
Faze projekta
Projekt je razdeljen na več faz, od katerih so začetne namenjene pripravi vzorcev za podrobne študije na biofizikalnem, strukturnem in celičnem nivoju. Faze karakterizacije na različnih nivojih potekajo delno vzporedno.
Rezultati
Rezultati, ki smo jih pridobili v okviru projekta, so bodisi v fazi objave oz. pred objavo zahtevajo podrobnejše/dodatne raziskave, zato jih ta trenutek ne moremo javno objaviti na spletni strani. Dostopni bodo po objavi v znanstvenih člankih.
Reference raziskovalne skupine, povezane s tematiko projekta
- Grison, M., Merkel, U., Kostan, J., Djinović-Carugo, K. & Rief, M. α-Actinin/titin interaction: A dynamic and mechanically stable cluster of bonds in the muscle Z-disk. Proc. Natl. Acad. Sci. 114, 1015–1020 (2017).
- Puž, V., Pavšič, M., Lenarčič, B. & Djinović-Carugo, K. Conformational plasticity and evolutionary analysis of the myotilin tandem Ig domains. Sci. Rep. 7, (2017).
- Drmota Prebil, S., Slapšak, U., Pavšič, M., Ilc, G., Puž, V., De Almeida Ribeiro, E., Anrather, D., Hartl, M., Backman, L., Plavec, J., Lenarčič, B. & Djinović-Carugo, K. Structure and calcium-binding studies of calmodulin-like domain of human non-muscle α-Actinin-1. Sci. Rep. 6, (2016).
- Gautel, M. & Djinović-Carugo, K. The sarcomeric cytoskeleton: from molecules to motion. J. Exp. Biol. 219, 135–145 (2016).
- Song, J.-G., Kostan, J., Drepper, F., Knapp, B., de Almeida Ribeiro, E., Konarev, P. V., Grishkovskaya, I., Wiche, G., Gregor, M., Svergun, D. I., Warscheid, B. & Djinović-Carugo, K. Structural Insights into Ca 2+ -Calmodulin Regulation of Plectin 1a-Integrin β4 Interaction in Hemidesmosomes. Structure 23, 558–570 (2015).
- Ribeiro, E. de A., Pinotsis, N., Ghisleni, A., Salmazo, A., Konarev, P. V., Kostan, J., Sjöblom, B., Schreiner, C., Polyansky, A. A., Gkougkoulia, E. A., Holt, M. R., Aachmann, F. L., Žagrović, B., Bordignon, E., Pirker, K. F., Svergun, D. I., Gautel, M. & Djinović-Carugo, K. The Structure and Regulation of Human Muscle α-Actinin. Cell 159, 1447–1460 (2014).
- Galkin, V. E., Orlova, A., Salmazo, A., Djinovic-Carugo, K. & Egelman, E. H. Opening of tandem calponin homology domains regulates their affinity for F-actin. Nat. Struct. Mol. Biol. 17, 614–616 (2010).
- Sjöblom, B., Salmazo, A. & Djinović-Carugo, K. α-Actinin structure and regulation. Cell. Mol. Life Sci. 65, 2688–2701 (2008).